O sector dos cuidados de saúde está a mudar para se adaptar às exigências mais modernas, em especial as dos doentes que optam pelo autotratamento.
Os medicamentos de venda livre (OTC) ganharam popularidade recentemente, uma vez que os doentes procuram cada vez mais flexibilidade para tomar conta da sua própria saúde. Durante anos, a U.S. Food and Drug Administration (FDA) colaborou com os criadores e produtores farmacêuticos para elaborar regras que aumentassem o acesso do público aos medicamentos OTC. Estes desenvolvimentos ajudam todas as partes envolvidas na cadeia de fornecimento de medicamentos, mas também podem ocasionalmente prejudicar os doentes.
Preocupações com a segurança e a qualidade dos produtos
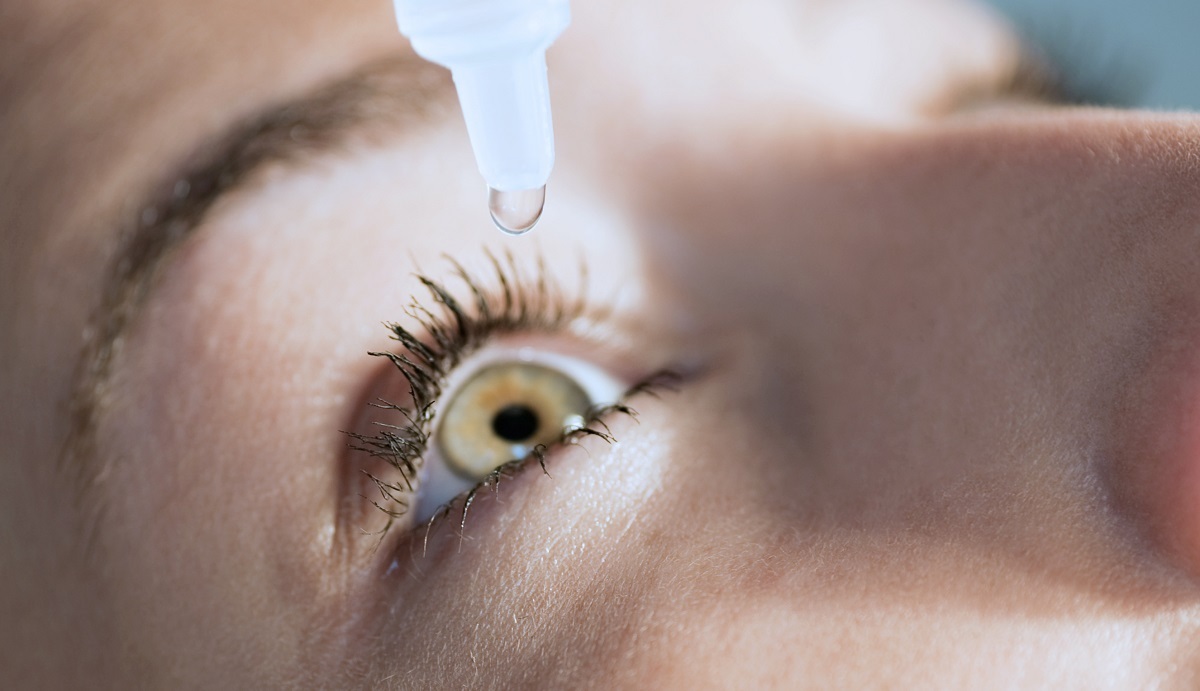
Os colírios são um medicamento de venda livre comum utilizado para tratar uma série de doenças oculares, incluindo alergias, infecções e olhos secos. No entanto, a FDA já recolheu quatro produtos de colírio até agora este ano devido a problemas com a segurança e qualidade do produto. Em fevereiro de 2023, os Centros de Controlo de Doenças (CDC) anunciaram que tinham identificado 55 doentes em 12 estados que tinham sido afectados por uma estirpe rara da bactéria Pseudomonas aeruginosa resistente aos medicamentos. Estas infecções causaram perda permanente de visão resultante de uma infeção da córnea, hospitalização e até uma morte.
Estes casos deveram-se a um produto de lágrimas artificiais destinado a hidratar os olhos secos que resultam de condições como o envelhecimento, alergias, efeitos secundários de outros medicamentos ou outras condições de saúde. A FDA recomendou esta recolha devido a violações das actuais Boas Práticas de Fabrico (BPF) da empresa, incluindo a falta de testes microbianos adequados, problemas de formulação e falta de controlos adequados relativamente a embalagens invioláveis. A FDA já está a colaborar com o CDC e com os departamentos de saúde estaduais e locais para investigar se mais pessoas foram afectadas por problemas com este fabricante e/ou outros colírios OTC.
Avisos de recolha
Devido a potenciais problemas de esterilidade que podem resultar em infecções oculares significativas, lesões ou deficiências visuais, a FDA acrescentou agora mais dois produtos para colírio à sua lista de recolha. Estas empresas não foram objeto de sanções civis (em contraste com a recolha anterior) porque não houve relatos de doenças ou lesões relacionadas com a utilização dos seus produtos.
Uma das recolhas foi iniciada porque as tampas de alguns dos frascos desenvolveram fracturas, o que pode permitir que bactérias, fungos ou outros micróbios contaminem os colírios. A outra recolha foi iniciada porque se verificou que o produto não era estéril, o que significa que pode conter contaminantes nocivos que podem causar infecções ou lesões oculares.
Melhores práticas para os fabricantes
Como mencionamos em nosso relatório 2023 State of the Nation Recall Index, agências reguladoras como a FDA estão se tornando mais agressivas quando se trata de retirar produtos que podem colocar em risco os consumidores. A FDA emitiu vários avisos devido à potencial contaminação, portanto, os fabricantes precisam garantir que suas instalações estejam em conformidade com todos os códigos de saúde relevantes. As empresas devem monitorizar de perto as alterações às suas obrigações legais e de conformidade para se certificarem de que a FDA e o CDC não têm qualquer razão para examinar os seus produtos.
Com a confiança das principais marcas mundiais, a Sedgwick já geriu mais de 5000 recolhas de produtos sensíveis e urgentes em mais de 100 países e 50 idiomas. Para saber mais sobre a nossa experiência no planeamento de recolhas, simulações e execução de eventos ao vivo, visite sedgwick.com/brandprotection.